Na solubilidade, o caráter polar ou apolar de uma substância influi principalmente, pois devido à polaridade, estas substâncias serão mais ou menos solúveis. Dessa forma, substâncias polares tendem a se dissolver em líquidos polares e substâncias apolares, em líquidos apolares, como já sabemos a água é um liquido polar, logo o urso «polar» irá dissolver-se na água enquanto o urso pardo «não polar» não se irá dissolver na água. Apesar de não ter a ver com a matéria atual achei piada.
Este blog é feito por um aluno do 9ºano e está a ser usado como instrumento de avaliação na disciplina de CFQ. Seja bem-vindo ao meu blog sinta-se livre para o apreciar e ficar espantado com o meu nivel de conhecimentos!!!!
Fisico-Quimica

Friday, January 24, 2014
Sunday, January 19, 2014
Substâncias Moleculares, Covalentes, Iónicas e Metálicas
Substâncias Moleculares
Unidade estrutural: Molecula
Ligações existentes: Ligações covalente
Exemplo: Açúcar
Propriedades:
- Têm pontos de fusão e ebulição baixas
- Algumas são solúveis em água e outras não
- Não conduzem corrente eléctrica
Substâncias Covalentes
Unidade estrutural: Átomos
Ligações existentes: Ligações covalentes
Exemplo: Grafite e diamante
Propriedades:
- Têm pontos de fusão e de ebulição elevados
- Não conduzem a corrente eléctrica
- São duras e quebradiças
Substâncias Iónicas
Unidade estrutural: Iões
Ligações existentes: Ligações iónicas
Exemplo: Cloreto de sódio
Propriedades:
- Têm pontos de fusão e ebulição elevados
- São, geralmente, solúveis com a água.
- No estado sólido não conduzem corrente elétrica, mas quando dissolvidas em água já o conseguem fazer
- São duras e quebradiças
Substâncias Metálicas
Unidade estrutural: Átomos (átomos positivos e eletrões livres)
Ligações existentes: Ligações metálicas
Exemplo: Cobre
Propriedades:
Propriedades:
Saturday, January 18, 2014
Ligação covalente
Como já deves ter percebido através de posts anteriores todos os elementos químicos se querem tornar estáveis, ou seja, todos querem ter o último nível de energia completo, alguns elementos perdem ou ganham eletrões transformando-se em iões e depois em substâncias iónicas, mas os elementos só podem perder e ganhar 3 eletrões como faz, por exemplo, um átomo do grupo 14? Pode se ligar a outros átomos através de ligações covalentes.
Mas afinal o que é uma ligação covalente?
Uma ligação covalente e a partilha de eletrões de valência entre dois átomos, ou seja dois átomos partilham eletrões com o objetivo de se tornarem mais estáveis, estas ligações podem ser:
- simples- é quando dois átomos partilham 2 eletrões de valência, um de cada átomo.
- duplas- é quando dois átomos partilham 4 eletrões de valência, dois de cada átomo.
- triplas- é quando dois átomos partilham 6 eletrões de valência, três de cada átomo
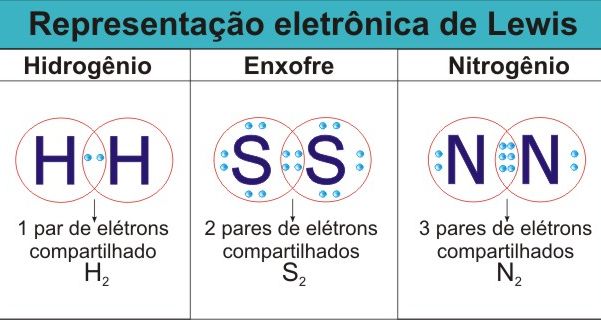
O que vemos na imagem acima é, por ordem esquerda-direita, uma ligação covalente simples, uma ligação covalente dupla e uma uma ligação covalente tripla. a representação que vemos feita chama-se notação de Lewis. Também se pode utilizar outra representação chamada formula de estrutura.
Cada traço representa um par de eletrões
Subscribe to:
Comments (Atom)

